CARBOHIDRATOS
Los glúcidos, carbohidratos, hidratos de carbono o sacáridos
son biomoléculas compuestas por carbono, hidrógeno y oxígeno, cuyas principales funciones en los seres
vivos son el prestar energía inmediata y estructural. La glucosa y el glucógeno son las formas biológicas primarias de
almacenamiento y consumo de energía; la celulosa cumple con una función estructural al
formar parte de la pared de las células vegetales, mientras que la quitina es el principal constituyente del exoesqueleto de los artrópodos.
El término "hidrato de carbono" o "carbohidrato" es
poco apropiado, ya que estas moléculas no son átomos de carbono hidratados, es
decir, enlazados a moléculas de agua, sino que constan de átomos
de carbono unidos a otros grupos funcionales
como carbonilo e hidroxilo. Este nombre proviene de la nomenclatura
química del siglo XIX, ya que las
primeras sustancias aisladas respondían a la fórmula elemental Cn(H2O)n
(donde "n" es un entero ≥ 3). De aquí que el término
"carbono-hidratado" se haya mantenido, si bien posteriormente se
demostró que no lo eran. Además, los textos científicos anglosajones insisten
en denominarlos carbohydrates lo que induce a pensar que este es su
nombre correcto. Del mismo modo, en dietética, se usa con más frecuencia la
denominación de carbohidratos.
Los glúcidos pueden sufrir reacciones de esterificación, aminación,
reducción, oxidación,
lo cual otorga a cada una de las estructuras una propiedad específica, como
puede ser de solubilidad
CARACTERISTICAS
Los glúcidos son compuestos
formados en su mayor parte por átomos de carbono e hidrógeno y, en una menor cantidad, de oxígeno. Tienen enlaces químicos difíciles de romper de tipo covalente, pero
que almacenan gran cantidad de energía, que es liberada cuando la molécula es oxidada.
En la naturaleza son un constituyente esencial de los seres vivos, formando parte de biomoléculas aisladas o asociadas a otras como
las proteínas y los lípidos, siendo los compuestos orgánicos más
abundantes en la naturaleza.
Los glúcidos cumplen dos papeles fundamentales en los seres vivos. Por
un lado son moléculas energéticas de uso inmediato para las células (glucosa) o que se almacenan para su posterior
consumo (almidón y glucógeno); 1g proporciona 4 kcal.
Por otra parte, algunos polisacáridos tienen una importante función estructural
ya que forman parte de la pared celular de los vegetales (celulosa) o de la cutícula de
los artrópodos.
Composición de hidratos de carbono
Pero... ¿cómo están compuestos estos macronutrientes? Pues bien, los hidratos de carbono están formados por moléculas de estos tres elementos químicos:- Carbono
- Hidrógeno
- Oxígeno
Fórmula general de los carbohidratos
Por otra parte, ten en cuenta que la fórmula general de los carbohidratos es:
(CH2O)n
Estructura química de los carbohidratos
Ahora bien, aunque la fórmula general es (CH2O)n, debes saber que la estructura química de los hidratos de carbono dependerá del tipo de azúcar de que se trate. Por tal razón, para entenderla es necesario que conozcas cómo se clasifican los carbohidratosCLASIFICACION
Monosacáridos
Los glúcidos más simples, los monosacáridos, estAn formados por una sola
molécula; no pueden ser hidrolizados a glúcidos más pequeños. La fórmula
química general de un monosacárido no modificado es (CH2O)n,
donde n es cualquier número igual o mayor a tres, su límite es de 7 carbonos.
Los monosacáridos poseen siempre un grupo carbonilo en uno de sus átomos de carbono y
grupos hidroxilo en el resto, por lo que pueden
considerarse polialcoholes. Por tanto
se definen químicamente como polihidroxialdehídos o polihidroxicetonas.
Los monosacáridos se clasifican de acuerdo a tres características
diferentes: la posición del grupo carbonilo, el número de átomos de carbono que contiene y su quiralidad. Si
el grupo carbonilo es un aldehído, el monosacárido es
una aldosa; si el grupo carbonilo es una cetona, el
monosacárido es una cetosa. Los monosacáridos más
pequeños son los que poseen tres átomos de carbono, y son llamados triosas; aquellos con cuatro son llamados tetrosas, los que poseen cinco son llamados pentosas, seis son llamados hexosas y aquellos con siete son llamados heptosas. Los sistemas de clasificación son
frecuentemente combinados; por ejemplo, la glucosa es una aldohexosa
(un aldehído de seis átomos de carbono), la ribosa es una aldopentosa
(un aldehído de cinco átomos de carbono) y la fructosa es una cetohexosa
(una cetona de seis átomos de carbono).
Cada átomo de carbono posee un grupo de hidroxilo (-OH), con la excepción del primero y
el último carbono, todos son asimétricos, haciéndolos centros estéricos con dos posibles configuraciones cada
uno (el -H y -OH pueden estar a cualquier lado del átomo de carbono). Debido a
esta asimetría, cada monosacárido posee un cierto número de isómeros. Por ejemplo la aldohexosa
D-glucosa, tienen la fórmula (CH2O)6, de la cual,
exceptuando dos de sus seis átomos de carbono, todos son centros quirales,
haciendo que la D-glucosa sea uno de los estereoisómeros posibles. En el caso del gliceraldehído, una aldotriosa, existe un par de posibles
esteroisómeros, los cuales son enantiómeros y epímeros (1,3-dihidroxiacetona, la cetosa correspondiente, es
una molécula simétrica que no posee centros quirales). La designación D o L es
realizada de acuerdo a la orientación del carbono asimétrico más alejados del
grupo carbonilo: si el grupo hidroxilo está a la derecha de la molécula es un
azúcar D, si está a la izquierda es un azúcar L. Como los D azúcares son los
más comunes, usualmente la letra D es omitida.
DISACARIDOS
Los disacáridos son glúcidos formados por dos moléculas de monosacáridos
y, por tanto, al hidrolizarse producen dos monosacáridos libres. Los dos
monosacáridos se unen mediante un enlace covalente conocido como enlace glucosídico, tras una reacción de
deshidratación que implica la pérdida de un átomo de hidrógeno de un
monosacárido y un grupo hidroxilo del otro monosacárido, con la consecuente
formación de una molécula de H2O, de manera que la fórmula de los
disacáridos no modificados es C12H22O11.
Algunos disacáridos comunes son:
OLIGOSACARIDOS
Estaquiosa, tetrasacárido formado por una glucosa, dos galactosas y una fructosa.
Los oligosacáridos están compuestos por tres a nueve moléculas de
monosacáridos2 que al hidrolizarse
se liberan. No obstante, la definición de cuan largo debe ser un glúcido para
ser considerado oligo o polisacárido varía según los autores. Según el número
de monosacáridos de la cadena se tienen los disacaridos (como la lactosa ), tetrasacárido (estaquiosa), pentasacáridos, etc.
Los oligosacáridos se encuentran con frecuencia unidos a proteínas, formando las glucoproteínas, como una forma común de
modificación tras la síntesis proteica.
Estas modificaciones post traduccionales incluyen los oligosacáridos
de Lewis, responsables por las incompatibilidades de los grupos sanguíneos,
el epítope alfa-Gal
responsable del rechazo hiperagudo en xenotrasplante y O-GlcNAc
modificaciones.
POLISACARIDOS
Los polisacáridos son cadenas, ramificadas o no, de más de diez
monosacáridos, resultan de la condensación de muchas moléculas de monosacáridos
con la pérdida de varias moléculas de agua. Su fórmula empírica es: (C6
H10 O5)n. Los polisacáridos representan una
clase importante de polímeros biológicos y su función en los organismos vivos está relacionada usualmente con
estructura o almacenamiento.
El almidón es la manera en
que las plantas almacenan monosacáridos; es una mezcla de
dos polímeros de glucosa, la amilosa y la amilopectina (ramificada).
Los animales usan el glucógeno en vez de almidón el cual es
estructuralmente similar pero más densamente ramificado. Las propiedades del
glucógeno le permiten ser metabolizado más
rápidamente, lo cual se ajusta a la vida activa de los animales con locomoción.
La celulosa y la quitina son ejemplos de polisacáridos
estructurales. La celulosa forma la pared celular de plantas y otros organismos y es
la molécula orgánica más abundante de la Tierra. La quitina tiene una
estructura similar a la celulosa, pero tiene nitrógeno en sus ramas incrementando así su
fuerza; se encuentra en el exoesqueleto
de los artrópodos y en las
paredes celulares de muchos hongos.
METABOLISMO DE LOS GLUCIDOS
Los glúcidos representan las principales moléculas almacenadas como
reserva en los vegetales. Los vegetales almacenan grandes
cantidades de almidón producido a partir de
la glucosa elaborada por fotosíntesis, y en mucha menor proporción, lípidos (aceites vegetales).
Los animales almacenan básicamente triglicéridos (lípidos). Al contrario que los
glúcidos, los lípidos sirven para almacenar y obtener energía a más largo
plazo. También almacenan cierta cantidad de glucógeno, sobre todo en el músculo y en el hígado. Aunque muchos tejidos y órganos animales
pueden usar indistintamente los glúcidos y los lípidos como fuente de energía,
otros, principalmente los eritrocitos y el tejido nervioso (cerebro), no pueden catabolizar los lípidos y deben ser continuamente
abastecidos con glucosa.
En el tubo digestivo los
polisacáridos de la dieta (básicamente almidón) son hidrolizados por las glucosidasas de los jugos digestivos, rindiendo
monosacáridos, que son los productos digestivos finales; éstos son absorbidos por las
células del epitelio intestinal e ingresan en el hígado a través de la circulación portal,
donde, alrededor del 60 %, son metabolizados. En el hígado, la glucosa
también se puede transformar en lípidos que se transportan posteriormente al tejido adiposo.
El músculo es un tejido en el que la fermentación representa una ruta metabólica muy
importante ya que las células musculares pueden vivir durante largos períodos
de tiempo en ambientes con baja concentración de oxígeno. Cuando estas células están trabajando
activamente, su requerimiento de energía excede su capacidad de continuar con el metabolismo oxidativo
de los hidratos de carbono puesto que la velocidad de esta oxidación está limitada
por la velocidad a la que el oxígeno puede ser renovado en la sangre. El
músculo, al contrario que otros tejidos, produce grandes cantidades de lactato que se vierte en la sangre y retorna al
hígado para ser transformado en glucosa, proceso metabólico conocido como ciclo de Cori.
Las principales rutas metabólicas
de los glúcidos son:
- Glicólisis. Oxidación de la glucosa a piruvato.
- Fermentación. La glucosa se oxida a lactato (fermentación láctica), o etanol y CO2 (fermentación alcohólica).
- Gluconeogénesis. Síntesis de glucosa a partir de precursores no glucídicos.
- Glucogenogénesis. Síntesis de glucógeno.
- Ciclo de las pentosas. Síntesis de pentosas para los nucleótidos.
En el metabolismo oxidativo encontramos rutas comunes con los lípidos
como son el ciclo de Krebs y la cadena respiratoria.
Los oligo y polisacáridos son degradados inicialmente a monosacáridos por
enzimas llamadas glicósido hidrolasas. Entonces los monosacáridos pueden entrar
en las rutas catabólicas de la glucosa.
SUPLEMENTOS CON CARBOHIDRATOS
PEDIALYTE - GLUCOSA MONOHIDRATADA
EXTRACTO DE MALTA- MALTOSA
ENSURE - ALMIDON
 |
| glucosa |
 |
| ALMIDÓN |
 |













 (en
(en  (en
(en 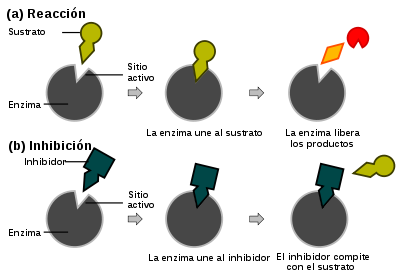


 puede ser bastante complejo, existe una etapa enzimática limitante que permite que el mecanismo sea simplificado como una etapa cinética única cuya constante es k2.
puede ser bastante complejo, existe una etapa enzimática limitante que permite que el mecanismo sea simplificado como una etapa cinética única cuya constante es k2. (Ecuación 1)
(Ecuación 1)

 (Ecuación 2)
(Ecuación 2)




 BROMELINA
BROMELINA  PAPAINA
PAPAINA
